1.2. MOLECOLE
Nomi, formule, modelli
Nelle formule chimiche utilizzate per indicare le molecole, il numero di atomi dello stesso tipo che fanno parte di una molecola si indica con un numero a pedice: quindi, la molecola dell’ossigeno, che è formata da due atomi di ossigeno, si rappresenta con la formula O2; la molecola dell’acqua, che è formata da due atomi di idrogeno e un atomo di ossigeno, si rappresenta con la formula H2O. Molte molecole sono costituite da un numero maggiore di atomi. Ad esempio, la molecola dell’acido acetico (Fig. 2a, a sinistra) è formata da 8 atomi, due di carbonio, quattro di idrogeno e due di ossigeno: C2H4O2. Ma ci sono molecole molto più complesse, come quella della vitamina B12, composta da 181 atomi: C63H88CoN14O14P (Fig. 2b, a sinistra).
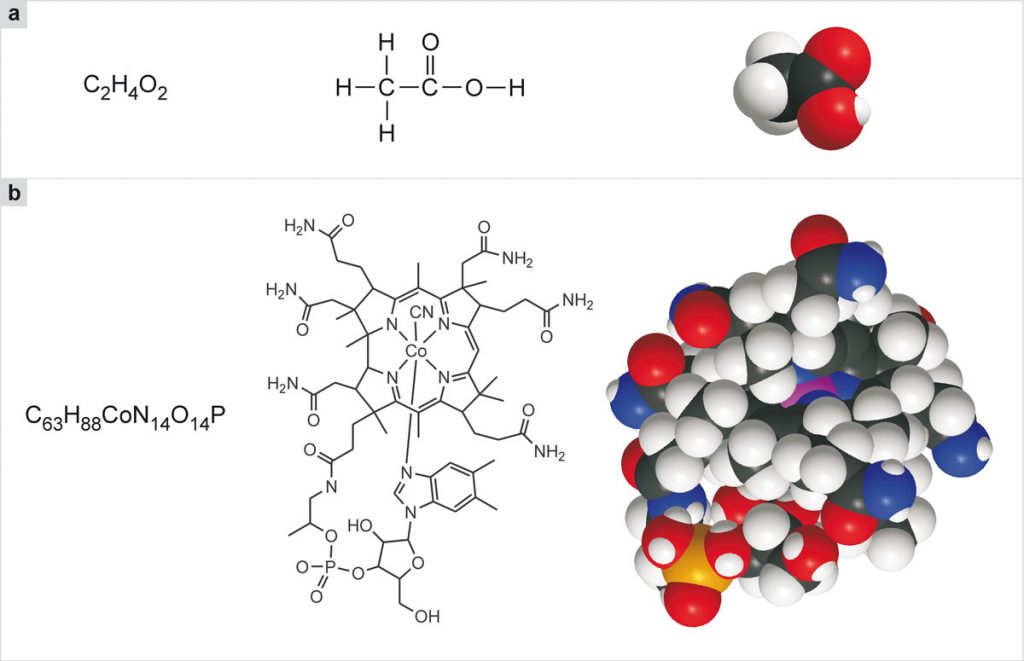
Come gli animali e le piante, le molecole hanno nomi comuni (acqua, acido acetico, vitamina B12) e nomi scientifici (nel caso dell’acqua, monossido di diidrogeno). I nomi scientifici delle molecole grandi sono estremamente complessi e quindi non sono quasi mai usati. Poiché i nomi non bastano per orientarsi nell’enorme e variegato mondo delle molecole, è necessario ricorrere ad un altro tipo di rappresentazione, che è quello delle formule. Quelle viste sopra, H2O, C2H4O2 e C63H88CoN14O14P, sono chiamate formule brute e indicano soltanto da quali e quanti atomi è composta la molecola. Queste formule non sono molto utili perché non specificano, dei vari atomi che compongono la molecola, chi-è-legato-a-chi e, tanto meno, la loro disposizione spaziale. Per esempio, 6 atomi di carbonio e 6 atomi di idrogeno possono combinarsi in 217 modi diversi e ciò significa che all’unica formula C6H6 corrispondono ben 217 molecole differenti, la più nota delle quali è il benzene. Questo esempio fa anche capire che, col centinaio di specie atomiche a disposizione, è possibile ottenere un numero enorme di molecole. Spesso si ricorre allora alle formule di struttura che evidenziano come sono legati fra loro i vari atomi.
In queste formule i legami, la “colla” che tiene assieme gli atomi, vengono rappresentati con trattini che uniscono i simboli degli atomi collegati. Per le molecole piccole le formule di struttura sono semplici e, oltre ad indicare chiaramente come sono legati gli atomi, riescono anche a dare un’idea della forma della molecola (Fig. 2a, al centro). Per le molecole grandi la situazione diviene via via più complessa e le formule di struttura finiscono per sembrare un’intricata ragnatela di segni. Si cerca, allora, di rappresentare la molecola con formule di struttura semplificate (Fig. 2b, al centro): ad esempio, gli atomi di carbonio, C, che sono molto comuni specialmente nelle molecole degli organismi viventi, non vengono più indicati esplicita- mente nella formula di struttura, ma si sottintende che occupino le posizioni di intersezione dei trattini che indicano i legami. Anche gli atomi di idrogeno, H, legati agli atomi di carbonio non vengono indicati, così come il trattino che rappresenta il loro legame.
Le formule di struttura sono molto utili agli scienziati, ma non si può certo dire che siano attraenti. Il modo più realistico e anche più significativo per rappresentare le molecole è quello basato sull’uso di modelli tridimensionali, enormemente ingranditi rispetto alla realtà. Questi modelli si costruiscono col meccanismo dell’incastro usato nel ben noto gioco del Lego, partendo da sferette di plastica rigida che rappresentano i vari tipi di atomi, dotate di piccole cavità nelle quali si possono inserire giunzioni che rappresentano i legami chimici. Ogni sferetta rappresentante un atomo è cento milioni di volte più grande della dimensione reale dell’atomo corrispondente, così che il modello è in scala e rappresenta quindi fedelmente le dimensioni relative delle varie molecole e delle parti che le costituiscono. Per distinguere i vari tipi di atomi, o meglio quelli più ricorrenti nelle molecole importanti, si usano colori convenzionali: bianco per l’idrogeno (H), nero per il carbonio (C), rosso per l’ossigeno (O), azzurro per l’azoto (N), giallo per lo zolfo (S), arancione per il fosforo (P), verde per il cloro (Cl).
Rappresentate con i modelli tridimensionali (Fig. 2, a e b, a destra), le molecole appaiono come oggetti macroscopici e acquistano parte del fascino che avrebbero se potessimo vederle nella loro realtà. Ma nel caso di molecole molto grandi, anche i modelli molecolari sono difficili da decifrare. Come vedremo più avanti, un ultimo modo per rappresentare le molecole più complesse e gli aggregati di molecole che costituiscono i congegni e le macchine molecolari è quello di utilizzare schemi di vario tipo capaci di far capire la forma, le proprietà e le funzioni del sistema in oggetto.