4.3. Nanovalvole: i farmaci diventano intelligenti
Per massimizzare l’efficacia terapeutica e minimizzare gli effetti collaterali, un farmaco dovrebbe idealmente agire all’interno dell’organismo solo dove e quando è necessario. Purtroppo nella realtà i farmaci non si comportano in questo modo: spesso non riescono a raggiungere l’obiettivo, magari perché vengono degradati dal sistema immunitario; oppure attaccano anche i tessuti sani. In alcuni casi il principio attivo permane troppo a lungo nell’organismo, causando reazioni avverse; in altri casi esso resta in circolo per un tempo troppo breve per risultare efficace. Un modo per ovviare a questi inconvenienti è quello di utilizzare sistemi di trasporto e rilascio controllato del farmaco (drug delivery). Tali sistemi sono sostanzialmente dei composti, o insiemi di composti, in grado di ospitare la molecola del farmaco, trasportarla nell’organismo e rilasciarla nel luogo opportuno e alla velocità giusta. Lo sviluppo di sistemi di trasporto e rilascio controllato efficienti, versatili e selettivi è indubbiamente uno dei temi di punta della ricerca farmacologica.
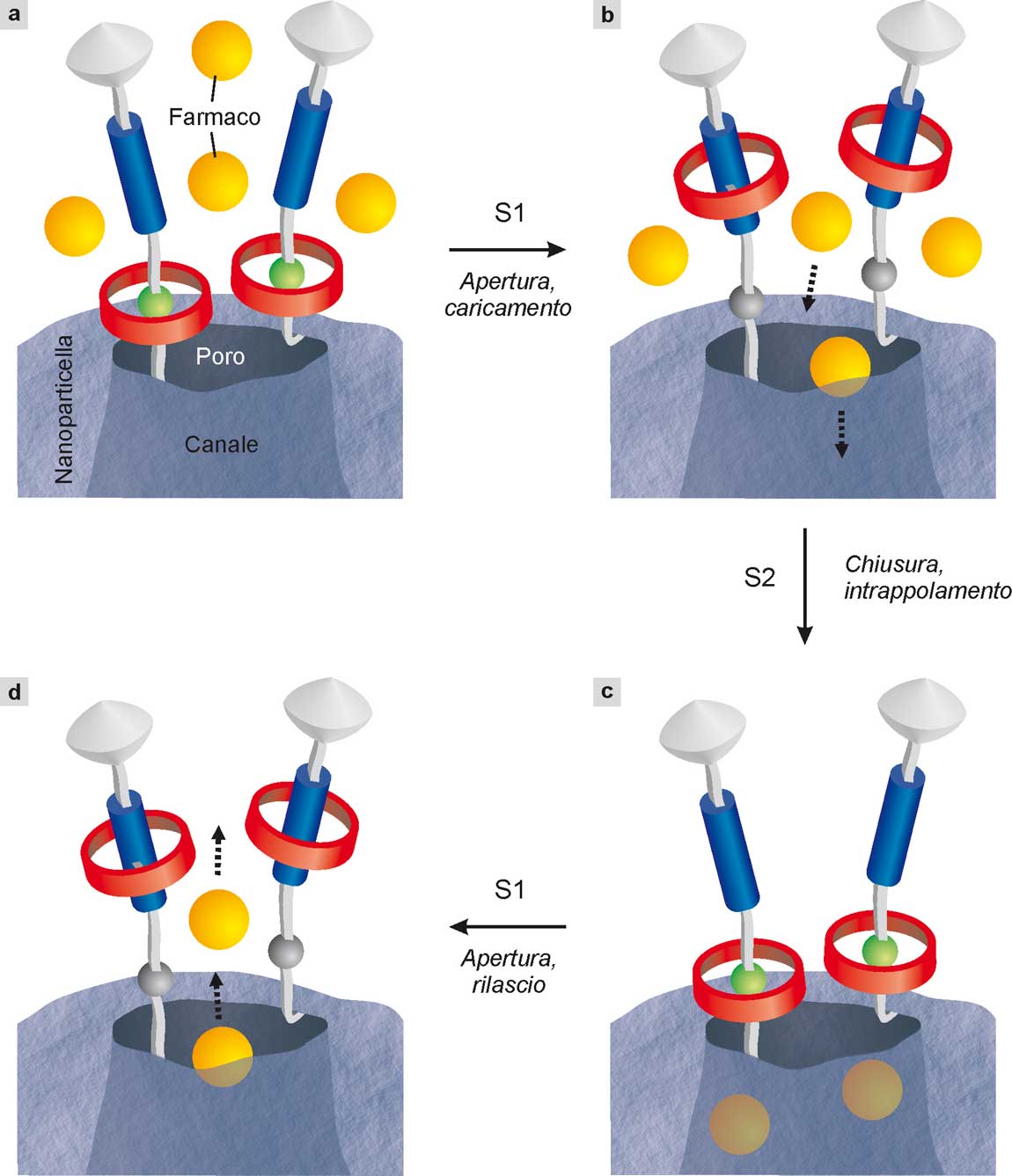
Le nanoparticelle di silice porosa sono interessanti in questo contesto perché possiedono al loro interno canali nei quali possono essere ospitate piccole molecole; inoltre sono stabili, biocompatibili, atossiche e facili da preparare. Per effettuare il rilascio controllato, però, è necessario disporre di una strategia che consenta di intrappolare il farmaco nella nanoparticella e di farlo uscire in seguito all’azione di uno stimolo endogeno (ad esempio un marcatore tumorale) o esterno (ad esempio la luce). Questo risultato è stato ottenuto sfruttando il movimento di macchine molecolari per aprire e chiudere l’ingresso dei pori che mettono in comunicazione i canali interni con la superficie della nanoparticella (Bruns 2017).
Come mostrato schematicamente nella Fig. 28, navette molecolari simili a quella descritta nella Fig. 20 sono state legate chimicamente alla superficie delle nanoparticelle, in prossimità dei pori. Gli esperimenti hanno dimostrato che i pori possono essere aperti e chiusi spostando gli anelli dei rotassani rispettivamente lontano e vicino rispetto all’ingresso dei pori stessi. La nanoparticella funzionalizzata con le macchine molecolari si comporta pertanto come una specie di valvola nanometrica (Fig. 28). Le proprietà di queste nanovalvole possono essere regolate modificando parametri strutturali come la lunghezza del connettore fra il rotassano e la superficie, la distanza fra le stazioni della navetta e la posizione iniziale dell’anello mobile. Mediante questo approccio sono state costruite nanovalvole comandate da stimoli luminosi, enzimatici o ionici (ad esempio variazioni di pH), capaci di ospitare e rilasciare molecole di vario tipo, fra cui complessi metallici, specie fluorescenti e farmaci antitumorali. Anche se siamo ancora molto lontani dal Viaggio allucinante di Asimov, queste ricerche danno un’idea delle potenzialità offerte dalle macchine molecolari in campo medico.