6. QUANTO COSTANO LE MALATTIE RARE?
Marianna Cavazza
Alla domanda «Quanto costano le malattie rare?», il lettore potrebbe chiedersi quale possa essere la differenza, per questo specifico ambito, rispetto al carico assistenziale e al volume di risorse assorbite dalle patologie più diffuse. Effettivamente, una significativa minore frequenza di casi di tali patologie comporta un altrettanto consistente maggiore sforzo, non solo in termini di conoscenze, ma anche di tempo e di risorse. Uno studio condotto tra USA e Gran Bretagna nel 2013 (Hendriksz 20131Hendriksz, C. (2013) Rare Disease Impact Report: Insights from patients and the medical community, Shire Human Genetic Therapies, April. ) ha evidenziato come, al di là di eventuali trattamenti farmacologici innovativi, non sempre presenti in tutte le patologie rare, si abbia effettivamente un incremento consistente di costi nel trattamento quotidiano dei pazienti affetti da malattie rare: nel caso della Gran Bretagna, è stato stimato pari a mediamente 7.000 sterline in più all’anno per paziente.
Emerge, in particolare, che non solo la diagnosi richieda mediamente cinque o sei anni, a causa dei due o tre fallimenti che frequentemente caratterizzano questa fase, ma che anche la singola visita specialistica risulti essere sempre maggiormente lunga, rispetto a quanto avviene per le altre patologie più diffuse. Altro aspetto da considerare è poi il numero di clinici mediamente coinvolto nella presa in carico di questi pazienti: in Gran Bretagna si tratta in media di otto clinici, un numero decisamente maggiore rispetto a quanto avviene per pazienti affetti, ad esempio, da artrite reumatoide o da patologie cardiocircolatorie (Hendriksz 2013). Nonostante queste evidenze, l’attenzione per il costo sostenuto dai pazienti affetti da malattie rare, dalle loro famiglie e dai sistemi sanitari è cresciuta solo negli ultimi tempi.
Una ricerca con le parole chiave rare disease ecost, svolta recentemente su uno dei principali motori ricerca della scienza medica, quale PubMed, ha rivelato che su 244 risultati più del 70% è stato pubblicato negli ultimi sei anni. L’interesse si è dapprima principalmente focalizzato sui farmaci disponibili per il trattamento di queste patologie, il loro costo e le modalità di accesso al mercato, concentrando l’attenzione sul ruolo e sull’onere che investe il soggetto terzo pagante in tali situazioni (Zamora et al. 20192Zamora, B., Maignen, F., O’Neill, P., Mestre-Ferrandiz, J., Garau, M. (2019) Comparing access to orphan medicinal products in Europe, Orphanet Journal of Rare Diseases, 14, article n. 95.). Si tratta naturalmente di un aspetto cruciale, soprattutto nel momento in cui si individua una nuova terapia farmacologica per una malattia fino a quel momento non curabile, ma d’altro canto non è l’unico elemento da considerare per affrontare la dimensione dei costi nell’ambito delle malattie rare. Forse, grazie anche all’incremento delle aspettative di vita, registrato per alcune malattie rare (Franchini, Mannucci 2017; Janssen et al. 2014), si è cominciato negli ultimi anni a superare questa limitata prospettiva, iniziando a considerare non solo gli oneri finanziari sostenuti dai soggetti terzi paganti, ma allargando l’analisi ai pazienti, alle loro famiglie e all’intera società.
Questo ampliamento di prospettiva ha comportato, a sua volta, una maggiore attenzione all’impatto delle risorse impegnate nel trattamento e nell’assistenza delle persone affette da malattie rare, non solo in termini di risultati clinici, ma anche di qualità della vita del paziente e dei suoi eventuali caregivers. È da sottolineare, infine, che questa prospettiva è anche presente in un documento di raccomandazioni del Gruppo di Esperti sulle Malattie Rare della Commissione Europea (CEGRD 2016), in cui si sottolinea la necessità di considerare e affrontare i bisogni di assistenza sociale, e nella gestione della vita quotidiana, richiesti da molti dei pazienti affetti da malattie rare.

In questo contributo si vogliono, quindi, proporre gli approcci e gli strumenti che hanno accompagnato l’appena descritta evoluzione dell’analisi dei costi, nell’ambito delle malattie rare, e i risultati finora ottenuti.
6.1. Approcci e strumenti per l’analisi dei costi delle malattie rare
In generale, la stima dei costi in campo sanitario richiede di soffermare l’attenzione su come si affrontano due aspetti chiave dell’analisi, e ciò vale ancora di più per le malattie rare, come si andrà a vedere. Da una parte, occorre valutare attentamente la prospettiva che si adotta nell’individuare i costi da stimare; dall’altra, è necessario interpretare il risultato ottenuto, considerando se le risorse consumate, e i relativi costi sostenuti, abbiano prodotto o meno il risultato atteso in termini di miglioramento delle condizioni di salute del paziente e/o del livello di qualità della vita.
Circa il primo aspetto, per “prospettiva”, in questo contesto, si intende il punto di vista del “proprietario” delle risorse impiegate, o a cui queste ultime sono riconducibili: se si considera, ad esempio, un trattamento che richiede una fase di assistenza ospedaliera e una territoriale, una rilevazione dei costi nella prospettiva dell’ospedale include le risorse esclusivamente riconducibili a quest’ultimo, come il personale medico e sanitario ospedaliero, i posti letto o i farmaci somministrati durante il ricovero. Altrettanto avviene nel caso si adotti la prospettiva dell’assistenza territoriale. È la prospettiva del Servizio Sanitario Nazionale (SSN) o Regionale (SSR) – ovvero del soggetto terzo pagante – a ricomporre, quindi, tutte le fasi di un trattamento e della relativa assistenza erogata dalle diverse articolazioni del sistema sanitario pubblico, oltre alle relative risorse utilizzate da queste ultime. Un simile approccio, a sua volta, esclude le risorse non riconducibili al SSN, quali, ad esempio, le eventuali spese di viaggio sostenute dal paziente, l’acquisto di beni e servizi non coperti dal SSN, o ancora l’assistenza informale erogata dai familiari, o da altre persone non professioniste, sempre non riconducibili al SSN. Queste voci saranno, invece, incluse nel momento in cui si adotta la prospettiva del paziente. È da considerare, infine, la prospettiva della società, che consente di comprendere le risorse impegnate dal SSN e dai singoli pazienti, ma anche “l’onere” della così detta perdita di produttività che la società
affronta in termini di eventuali pensioni di invalidità per i pazienti, e/o di pensionamento anticipato e di minore capacità di contribuzione fiscale da parte sia degli stessi pazienti, sia dei familiari che forniscono assistenza informale (Drummond et al. 20103Drummond, M., Schulpher, M. J., Torrance, G. W., O’Brien, B. J., Stoddart, L. G. (2010) Metodi per la valutazione economica dei programmi sanitari, Torino: Il pensiero scientifico.).
Emerge evidente come la prospettiva adottata, nell’ambito di una rilevazione dei costi, abbia un impatto determinante sul risultato finale, e come la scelta sia legata a una serie di elementi quali l’oggetto e la finalità dell’analisi, le fonti informative utilizzabili e le risorse disponibili per svolgere l’analisi stessa.
Nel caso delle malattie rare, la prospettiva più efficace è quella della società, poiché si tratta per la maggior parte di patologie che comportano elevati costi di trattamento, con ricadute sul soggetto terzo pagante pubblico, e/o altamente invalidanti con elevati oneri sia per la famiglia in termini di assistenza, sia per la società rispetto alla perdita di produttività (López-Bastida et al. 20164López-Bastida, J., Oliva-Moreno, J., Linertova, R., Serrano-Aguilar, P. (2016) Social/economic costs and health-related quality of life in patients with rare diseases in Europe, European Journal of Health Economics, 17(Suppl. 1): S1-S5.). Ad esempio, una patologia come l’emofilia è in genere caratterizzata dalla prescrizione di farmaci particolarmente costosi (90% dei costi diretti sanitari) e potrebbe condurre a focalizzare l’attenzione sulla prospettiva del soggetto terzo pagante, benché l’incremento dell’attesa di vita stia aumentando l’attenzione anche su altre risorse e i relativi costi (Kodra et al. 20145Kodra, Y., Cavazza, M., Schieppati, A., De Santis, M., Armeni, P., et al. (2014) The social burden and quality of life of patients with haemophilia in Italy, Blood Transfusion, 12(Suppl. 3): S567-S575.). Nel caso, invece, di un paziente affetto da una patologia altamente invalidante come la Duchenne, il consumo di farmaci è irrilevante e quello di prestazioni sanitarie molto ridotto, al contrario del carico assistenziale fornito in genere dalla famiglia (Cavazza et al. 20166Cavazza, M., Kodra, Y., Armeni, P., De Santis, M., López-Bastida, J., et al. (2016) Social/economic costs and health-related quality of life in patients with Duchenne muscular dystrophy in Europe, European Journal of Health Economics, 17(Suppl. 1): S19-S29.) (cfr. Figg. 10 e 11).
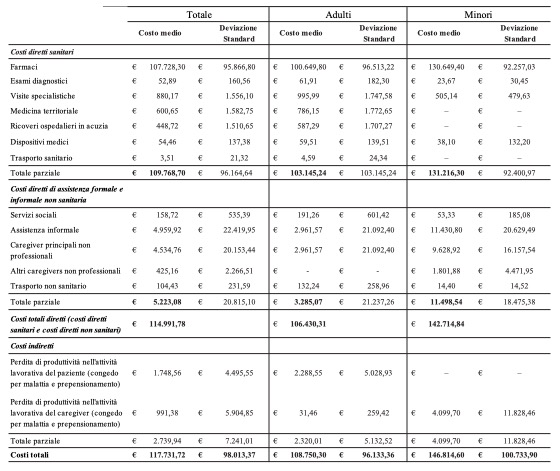
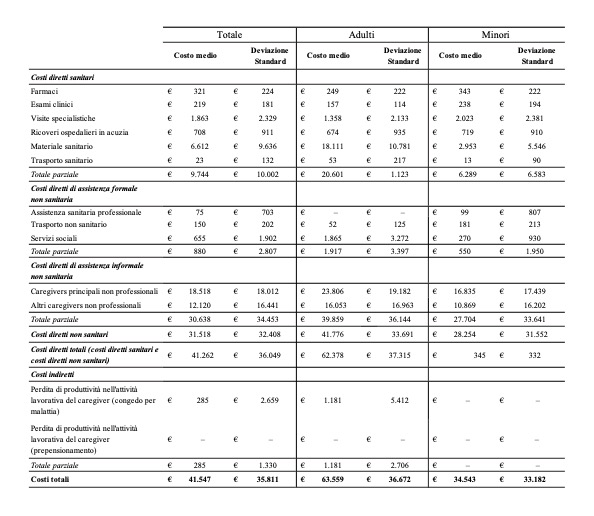
Dato questo contesto, una nuova interpretazione di un tradizionale strumento dell’analisi costi e benefici, quale il costo della malattia (Cost Of Illness, COI), rappresenta l’approccio sempre più utilizzato nell’ambito delle malattie rare (López-Bastida et al. 2016). Consente, infatti, di fornire una descrizione esaustiva del carico sociale sulla comunità, individuando tutti gli attori effettivamente coinvolti, evidenziando le voci di costo predominanti (ad esempio, farmaci o assistenza informale) e analizzando l’origine di una eventuale variabilità dei costi, riconducibile ai diversi contesti e assetti organizzativi (Tarricone 20067Tarricone, R. (2006) Cost-of-illness analysis. What room in health economics? Health Policy, 77: 51-63.).
Il secondo elemento chiave, ossia interpretare il risultato ottenuto dall’analisi dei costi, si basa sul presupposto che esaminare il valore monetario delle risorse, mediamente consumate per il trattamento e l’assistenza di un paziente affetto da una determinata patologia, fornisca sicuramente indicazioni importanti, ma racconti in qualche modo solo una parte della storia. Infatti, il passaggio successivo, per rappresentare pienamente il valore effettivo dei costi sostenuti, è costituito dal confronto di questi ultimi con il risultato delle prestazioni per cui sono state usate le risorse valorizzate (Drummond et al. 2010). In questa prospettiva, il principale strumento da utilizzare nell’ambito delle malattie rare è la qualità della vita in relazione allo stato di salute (Health-Related Quality of Life, HRQoL) (López-Bastida et al. 2016). Si tratta di una “rivisitazione” da parte della scienza medica della nozione di qualità della vita, elaborata dalle scienze sociali e dalla psicologia: specificatamente, tra le diverse determinanti della qualità della vita, si considerano solo la salute e gli aspetti a essa correlati. Tale approccio, quindi, consente di restare nel perimetro della missione medica e di esaminare gli aspetti della vita quotidiana, effettivamente modificabili da interventi medici. Quindi, la HRQoL fornisce indicazioni, in base alla percezione del paziente e alle sue oggettive capacità funzionali, circa il livello di benessere fisico, mentale e sociale riconducibile al suo stato di salute (Ierardi et al. 20108Ierardi, F., Gnaulati, L., Maggino, F., Rodella, S., Ruviglioni, E. (2010) La Health Related Quality of Life (HRQoL): analisi dell’evoluzione di un concetto, intervento alla conferenza “Qualità della vita: riflessioni, studi e ricerche in Italia”, Firenze, 9-10 settembre.). Tali rilevazioni possono essere svolte utilizzando un’ampia gamma di scale specifiche per patologia o generali, tra le quali una delle maggiormente utilizzate è la famiglia di scale EQ-5D insieme alla Zarit relativa, invece, all’impatto dell’assistenza informale sulla qualità della vita del caregiver.
6.2. Risultati
Un’applicazione su larga scala di tali approcci e strumenti è stata fornita dal progetto Social Economic Burden and Health-Related Quality of Life in Patients with Rare Diseases in Europe (BURQoL-RD), promosso a partire dal 2010 dalla DG SANCO della Commissione Europea, per rilevare il carico sociale di dieci malattie rare (fibrosi cistica, sindrome di Prader-Willi, emofilia, distrofia muscolare di Duchenne, epidermolisi bollosa, sindrome dell’X fragile, sclerodermia, mucopolisaccaridosi, artrite idiopatica giovanile e istiocitosi) in otto paesi dell’Unione Europea (Bulgaria, Francia, Germania, Ungheria, Italia, Spagna e Gran Bretagna). L’approccio basato sul costo della malattia fa emergere, nell’ambito di ciascuna patologia, una forte variabilità in termini di costi, riconducibile ai diversi assetti organizzativi, istituzionali e non, alla differente componente di assistenza formale e informale erogata, così come al diverso livello di accessibilità ai farmaci. Altrettanto variabile risulta essere la HRQoL dei pazienti e dei loro eventuali caregivers, in seguito anche al diverso volume di risorse messe in campo dalle istituzioni sanitarie e dalla società (López-Bastida et al. 20169López-Bastida, J., Oliva-Moreno, J., Linertova, R., Serrano-Aguilar, P. (2016) Social/economic costs and health-related quality of life in patients with rare diseases in Europe, European Journal of Health Economics, 17(Suppl. 1): S1-S5.).
Alcune analisi, svolte a latere del progetto BURQoL, hanno poi confermato che in genere un maggior consumo di risorse, e quindi un maggior costo, si traduce in livelli della HRQoL più elevati. Un esame più specifico di questa relazione è stato, quindi, svolto rispetto alla popolazione italiana di pazienti emofiliaci, arruolati sempre nell’ambito del progetto BURQoL (Kodra et al. 201410Kodra, Y., Cavazza, M., Schieppati, A., De Santis, M., Armeni, P., et al. (2014) The social burden and quality of life of patients with haemophilia in Italy, Blood Transfusion, 12(Suppl. 3): S567-S575.): ne emerge che un incremento di un punto nella scala di misurazione della HRQoL, utilizzando gli strumenti EQ-5D ed EQ-VAS, comporta una diminuzione dei costi della malattia (217€ all’anno) al netto di quelli sostenuti per i farmaci. Seppure questi ultimi rappresentino la voce di costo più rilevante per questa patologia, il risultato va letto nella prospettiva dell’incremento delle aspettative di vita dei pazienti emofiliaci, avvenuta negli ultimi decenni. Infatti, un’ulteriore analisi circa la relazione tra la tendenza dei costi, sempre al netto dei farmaci, e l’età indica come l’andamento sia uguale a quello della popolazione sana, con un incremento nei primi anni di vita (0-4 anni) a cui segue una diminuzione costante negli anni successivi, fino ai 46 anni di età, quando i costi iniziano di nuovo ad aumentare.
6.3. Conclusioni
Provando a riprendere la domanda iniziale circa il costo delle malattie rare, la risposta è che in genere costano di più delle altre patologie croniche più diffuse, come evidenziano i dati sopra riportati (Hendriksz 2013). La domanda diventa, quindi, quanto costano in più e la risposta – sempre temuta dai policy-maker e tipica delle situazioni complesse – è: dipende. Dipende, naturalmente, dalla patologia e dalle risorse che richiede di mettere in campo, così come dagli assetti organizzativi, istituzionali e non, e così via. Ciò che sicuramente accomuna queste patologie è, comunque, la complessità della loro presa in carico e la loro gestione. Da qui emerge la necessità di utilizzare la prospettiva della società, per riuscire a tenere conto di tutti gli attori coinvolti e delle risorse effettivamente consumate.
È, infine, importante continuare ad approfondire l’analisi della relazione tra i costi sostenuti e la HRQoL, poiché è probabilmente il modo migliore per rispondere alla domanda relativa a quanto effettivamente costano le malattie rare.