7. PER UN’EPISTEMOLOGIA E UN’ETICA DEL CASO SINGOLO
Raffaella Campaner, Silvia Zullo
Questo contributo intende fornire alcuni spunti di riflessione sulle malattie rare, affrontate dal punto di vista dell’epistemologia e della bioetica. Si tratta di due sguardi distinti, ma in chiara relazione l’uno con l’altro, che riteniamo possano far emergere aspetti rilevanti, insiti nei nostri modi di affrontare le malattie rare, tanto nella ricerca biomedica quanto nella clinica.
7.1. Modelli e casi singoli
Nel portale di EURORDIS-Rare Diseases Europe, organizzazione non governativa internazionale che rappresenta pazienti affetti da 894 malattie rare, si legge che una malattia rara, nota anche come malattia orfana, è una malattia che colpisce una piccola percentuale della popolazione. «In Europa, una malattia o un disturbo è definito come raro quando colpisce meno di 1 su 2.000 cittadini […] Queste malattie sono caratterizzate da un’ampia diversità di disordini e sintomi, che variano non solo da malattia a malattia, ma anche da paziente a paziente affetto dalla stessa condizione». In che modo tale “varietà” costituisce qualcosa di peculiare e impatta sulla costruzione e l’utilizzo della conoscenza medica?
È facile convenire che la scienza mira all’individuazione di pattern regolari nei fenomeni, e alla costruzione di modelli che li rappresentino in modo efficace. I modelli vengono elaborati attraverso procedure di astrazione e idealizzazione, fornendo dei quadri di riferimento in cui la patologia viene raffigurata nelle sue caratteristiche ideali. Compito del medico sarà istituire i corretti rapporti tra il modello generale e il singolo paziente, che non presenta mai tutti e solo gli elementi esplicitati nel modello. La capacità di cogliere correttamente tali rapporti è importante nella definizione stessa di un ambito disciplinare: «Cogliere le caratteristiche distintive di una disciplina significherà, tra l’altro, valutare il rapporto peculiare, per natura o grado, che si instaura in essa tra questi due aspetti: fatti singoli e modelli di portata generale» (Gabbani 2013, p. 151Gabbani, C. (2013) Epistemologia e clinica, Pisa: ETS.).
Su questa questione, che interroga direttamente il rapporto tra ricerca biomedica e pratica clinica, è possibile innestare ulteriori riflessioni, lungo vari assi. Da un punto di vista prettamente teorico e di principio, ci sono ragioni per privilegiare porzioni di conoscenza generalizzabili o, quanto meno, ampiamente applicabili, rispetto a informazioni riferite unicamente al caso individuale – e quindi, in un contesto medico, per preferire conoscenza su condizioni “tipiche” rispetto a ricerche su condizioni rare? In una prospettiva epistemologica, il ruolo di forme di conoscenza generale è oggetto di dibattito. La conoscenza empirica muove dall’osservazione di casi singoli e, «sebbene ci possa essere una regolarità in corrispondenza di ogni fatto singolo, non è la regolarità a costituire la verità della proposizione singolare, né è necessaria per la sua conferma. […] Le regolarità non hanno alcuna posizione [epistemologica] privilegiata. Le asserzioni singolari possono essere stabilite in modo altrettanto affidabile» (Cartwright 2000, pp. 47-482Cartwright, N. (2000) An Empiricist Defense of Singular Causes, Royal Institute of Philosophy Supplement, 46: 47-58.). Inoltre, che i fenomeni siano governati da regolarità è un’assunzione, e può essere messa in discussione. Il mondo potrebbe, infatti, rivelarsi dominato da variazioni, piuttosto che da ripetizioni, da disordine piuttosto che da ordine (Dupré 1993; Cartwright 1999). La convinzione che forme di conoscenza generale, in grado di unificare progressivamente un numero via via maggiore di casi, forniscano necessariamente una migliore comprensione del mondo, e siano pertanto preferibili, non può essere data per scontata.
In un quadro che problematizza la relazione tra modelli generali e casi particolari, quale ruolo riconoscere a patologie rare? Si tratta di casi problematici da marginalizzare – per ragioni epistemologiche e/o pragmatiche – o di risorse epistemiche? Se, da un lato, le malattie che si manifestano con frequenza particolarmente bassa tendono a essere concepite come fonti di difficoltà, dall’altro lato, almeno due aspetti invitano alla riflessione. Un fenomeno largamente discusso nella letteratura internazionale è il cosiddetto disease mongering, ovvero la promozione a malattia di una condizione largamente diffusa entro una certa popolazione, rendendola pertanto oggetto di trattamento (cfr. ad esempio, Wolinsky 2005, p. 6123Wolinsky, H. (2005) Disease Mongering and Drug Marketing, EMBO Reports, 6(7): 612-614.). Paradossalmente, ci si trova così in una situazione in cui la ricerca fatica a trovare nuove e specifiche cure per pochi pazienti, effettivamente colpiti da malattie rare, e, al tempo stesso, vengono “inventate” malattie tramite la ricategorizzazione di condizioni di routine in condizioni patologiche. La questione più ampia, sottesa, è la definizione di “normalità”, da cui il patologico emerge per differenza: quale normalità – naturale/funzionale, statistica, convenzionale – assumiamo? Chi è titolato a fissarne le soglie?
Un altro elemento interessante è dato dall’ampia letteratura medica sui casi di studio, focalizzata su problemi che emergono «in situazioni in cui la diagnosi sarebbe particolarmente difficile o complicata, e descrivono occorrenze cliniche non comuni o persino ‘uniche’. […] I casi singoli colgono eccezioni o manifestazioni fortemente insolite di condizioni di salute e malattia» (Ankeny 2017, pp. 310-3114Ankeny, R. A. (2017) The case study in medicine. In: M. Solomon, J. Simon, H. Kincaid, eds., The Routledge Companion to Philosophy of Medicine, London: Routledge, pp. 310-318.), in cui spesso c’è «un elemento di sorpresa» (Jenicek 2001, p. 835Jenicek, M. (2001) Clinical-Case Reporting in Evidence-Based Medicine, London: Arnold.). Lo spazio dedicato ai casi di studio – inclusa la creazione, ad esempio, della rivista Journal of Medical Case Reports nel 2007 – testimonia il riconoscimento del loro ruolo epistemico: i casi di studio sono casi singoli non semplicemente in un senso numerico, ma in quanto introducono una qualche novità a livello descrittivo/esplicativo/terapeutico, ed è per questa ragione che si ritiene valga la pena di considerarli. Il processo, che segna la dinamica della costruzione di conoscenza tra livello generale e caso individuale, sarà poi di tipo iterativo. La descrizione di un caso individuale effettivo viene messa in relazione con conoscenze ampie già acquisite, astraendo progressivamente da alcune caratteristiche per evidenziare somiglianze con ciò che è già noto.
A sua volta, la conoscenza generale può essere confermata o, viceversa, corretta e perfezionata, alla luce delle peculiarità del caso individuale (cfr. Ankeny 2006). I casi singoli stimolano nuovi processi conoscitivi, incoraggiano nuove scoperte, fanno emergere anomalie e limiti delle teorie già accreditate, e stimolano la creazione di nuovi approcci. I casi rari possono così svolgere un ruolo importante non in senso statistico, nella costruzione di una qualche media o standard di riferimento, ma come pietra di confronto e controllo per i modelli accettati dalla scienza del momento. L’individuo affetto da una patologia rara è rilevante non perché esemplifica almeno alcune regolarità tipiche del corpo umano e del suo funzionamento (cosa che senz’altro fa), ma proprio perché presenta caratteristiche distintive, non-tipiche. Al tempo stesso, non si deve escludere a priori che anche le caratteristiche peculiari possano avere, in ultima analisi, una portata sovra-individuale e fornire contenuti conoscitivi che si rivelano poi rilevanti anche su larga scala.
Concludendo le nostre riflessioni epistemologiche, chiediamoci allora: in che senso la medicina può – e, almeno in parte, deve – essere una scienza dell’individuale? Senz’altro non per ragioni di immaturità disciplinare, bensì per l’alta variabilità del suo oggetto di indagine, il soggetto malato. Se una medicina “dell’individuo”, anche nell’accezione di individuo con patologia rara, può incontrare difficoltà, è importante riconoscerne tutta la gamma dei possibili impatti rispetto ai metodi della ricerca scientifica, ai contenuti della formazione del medico, e, come vedremo nel paragrafo seguente, a dilemmi etici. Se è crescente la consapevolezza – grazie, ad esempio, ai progressi della ricerca oncologica – dell’unicità, in realtà, di ogni malato, le malattie rare ci ricordano con forza come le differenze siano fondamentali dal punto di vista epistemologico. La diversità ha a che fare «sia con la salute che con la malattia, ovvero gli esseri umani sono diversi sia quando sono sani che quando divengono pazienti» (Gabbani 2013, p. 376Gabbani, C. (2013) Epistemologia e clinica, Pisa: ETS.). Lo status di individuale, in altri termini, è uno status non provvisorio, ma permanente. Il paziente non è un essere indifferenziato, e tanto la ri- cerca medica quanto la pratica clinica non possono prescindere da questo. Al medico si richiede pertanto di agire «interpretando i casi alla luce delle regole, e rivedendo le regole alla luce dei casi» (Montgomery 1991, p. 477Montgomery, K. (1991) Doctor’s Stories, Princeton: Princeton University Press.) – inclusi, e forse soprattutto, i casi rari.
7.2. Questioni bioetiche
Le malattie rare, considerate dalla prospettiva bioetica, sollevano dilemmi morali e problemi di giustizia sociale, distributiva e allocativa, estremamente complessi e riconducibili, in sintesi, a tre questioni principali (Barrera, Galindo 20108Barrera, L. A., Galindo, G. C. (2010) Ethical aspects on rare diseases. In: M. Posada de la Paz, S. Groft, eds., Rare Diseases Epidemiology, Dordrecht: Springer (Advances in Experimental Medicine and Biology, vol. 686), pp. 493-511.). La prima questione è relativa a un quadro empirico che pone in evidenza la netta sproporzione tra i bisogni dei pazienti affetti da malattie rare e la loro soddisfazione (unmet needs), cioè tra il numero delle persone affette da malattie rare e i trattamenti realmente efficaci disponibili. Qui i dilemmi morali più rilevanti riguardano le “scelte difficili”, ossia l’accesso alla somministrazione di terapie non solo sperimentali, ma anche non validate, il cosiddetto “uso compassionevole” dei farmaci e dei trattamenti, che rappresentano l’unica alternativa disponibile, facendo così emergere la necessità di un percorso di accesso alle terapie che sia efficace, trasparente e quindi etico.
Il secondo aspetto riguarda le questioni di giustizia sociale, distributiva e allocativa, quindi le procedure e i criteri di sostenibilità, per quel che concerne la distribuzione e l’accesso alle risorse sanitarie pubbliche. Nell’impossibilità di garantire tutto a tutti, in linea di principio si dovrebbe almeno considerare l’imperativo morale di garantire tutto quanto risulta efficace a tutti coloro che ne hanno bisogno in quanto ogni paziente ha il diritto di essere curato in modo uguale rispetto a qualsiasi altro. Su questo versante sono numerosi i nodi da sciogliere, che interessano i nuovi farmaci e le terapie innovative per quel che riguarda lo sviluppo clinico, l’eticità della sperimentazione e l’accesso al mercato (Juth 20179Juth, N. (2017) For the Sake of Justice: Should We Prioritize Rare Diseases?, Health Care Analysis, 25: 1-20.).
La terza questione riguarda la non trascurabilità del rights-based approach nelle scelte di politica sanitaria. Qui, infatti, si impone la necessità di una governance che, sul piano nazionale e internazionale, sia strutturata secondo criteri etici e dispositivi giuridici tesi a garantire il diritto alla salute di tutti, tramite misure e orientamenti di principio in linea con le Dichiarazioni sui diritti umani (ONU 2007) e con la nostra Carta costituzionale (principi di uguaglianza, solidarietà, dignità e sviluppo della persona).

Per quel che riguarda la prima questione, i principali interrogativi di natura etica vertono attorno alla libertà e al diritto di accesso a terapie che, seppur non ancora autorizzate, siano almeno entrate in fase di sperimentazione e per le quali siano disponibili risultati di studi clinici. Infatti, nella maggior parte dei casi, sono disponibili farmaci orfani, o per meglio dire farmaci per malattie orfane, quali sono le malattie rare, che, a causa degli elevati costi di sperimentazione, vedono le aziende farmaceutiche solitamente restie a svilupparli secondo le normali condizioni di mercato. D’altra parte, quando disponibili, i trattamenti e i farmaci per la cura delle malattie rare sono molto costosi pur non essendo, in più casi, documentata la loro efficacia e sicurezza, e per queste ragioni gli interventi cosiddetti “orfani” sono spesso disincentivati rispetto a quelli più convenzionali che, seppur limitati nell’efficacia, tuttavia si applicano a popolazioni più vaste di pazienti. Il QALY (Quality-Adjusted Life-Year) è lo strumento più utilizzato per stabilire il valore di un farmaco e serve per misurare la qualità di vita del paziente in riferimento a un trattamento (Fig. 12) (Williams 199610Williams, A. (1996) QALYS and ethics: A health economist’s perspective, Social Science and Medicine, 43(12): 1795-1804.).
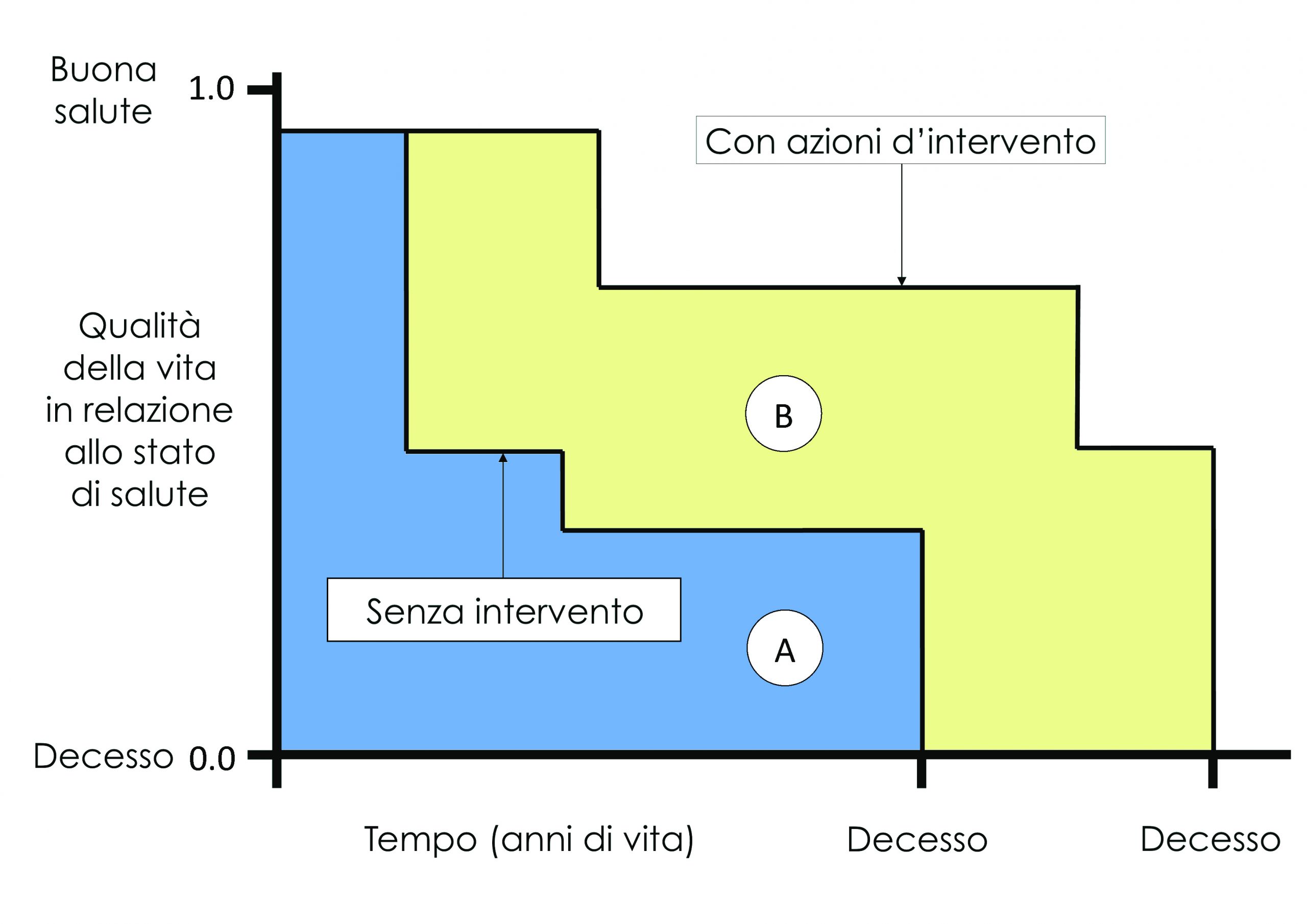
Il costo di una terapia, in rapporto al QALY, rappresenta una misura costo-efficacia per stabilire la convenienza di un trattamento rispetto ad altri; tuttavia il valore generato dal QALY è puramente statistico e si basa su un calcolo complessivo, che non tiene conto delle condizioni specifiche di ciascun paziente interessato al trattamento. Ciò ha evidenti implicazioni etiche che si ripercuotono sull’adozione di una logica prevalentemente economica e utilitaristica, cioè basata sul solo criterio dell’analisi costo-efficacia, laddove non si tiene sufficientemente in considerazione il bilanciamento con i fondamentali principi bioetici, in particolare il principio di beneficenza, orientato all’agire sempre per il bene del paziente, e il principio di giustizia, orientato alla tutela dell’equità in salute (Beauchamp, Childress 199911Beauchamp, T. L., Childress, J. F. (1999) Principi di Etica Biomedica, Firenze: Le Lettere.). Si tratta di principi che tendono a considerare rilevante la salute dei singoli individui e non solo la massimizzazione del benessere generale. Volendo adottare un’etica che vada oltre il dato economico e la prospettiva utilitaristica, le misure costo-efficacia non possono essere disgiunte da un’attenzione più specifica, per la condizione di sofferenza delle persone affette da malattie rare, e da un impegno solidale per la promozione del loro stato di salute, in conformità ai suddetti principi bioetici della cura.
Circa la seconda questione, i problemi di giustizia sociale in questo ambito intersecano il requisito etico della equità in salute e il concetto di salute possibile. Sono due aspetti che si traducono nell’impossibilità di decidere le questioni di giustizia distributiva e allocativa, assegnando a tutti la stessa quota di risorse. Si tratta di una tensione che, nel campo della salute, implica il dover tenere conto della diversa distribuzione naturale e sociale delle malattie e dei deficit psicofisici, quindi dei differenti gradi di intervento, per garantire a ciascuno la sua salute possibile. Ciò è particolarmente evidente laddove la ricerca e lo sviluppo di farmaci, terapeuticamente efficaci per le malattie rare, sono ancora “sotto accusa” nel sistema sanitario pubblico, poiché richiederebbero un investimento di entità tale da essere percepito come contrastante con gli interessi e il diritto alla cura di tutti gli altri cittadini, affetti da patologie comuni (Rai 200212Rai, A. (2002) Pharmacogenetic interventions, orphan drugs, and distributive justice: the role of cost-benefit analysis, Social Philosophy and Policy, 19(2): 246-270.). Qui giova sottolineare, come emerge dal quadro epistemologico illustrato in questo capitolo, che la contrapposizione tra malattie rare e malattie comuni è diventata via via più sfumata, nelle rappresentazioni pubbliche e medico-scientifiche, e a questo proposito è stato dimostrato come certi farmaci orfani costituiscano un potenziale terapeutico anche per malattie non rare, evidenziando l’utilità delle malattie rare per comprendere le malattie comuni (Stolk et al. 2006; Wästfelt et al. 2006).
Questo passaggio ci porta a considerare l’ultimo aspetto circa la rilevanza del rights-based approach (Daniels 199813Daniels, N. (1998) Is there a right to health care and, if so, what does it encompass?. In: H. Kuhse, P. Singer, eds., A Companion to Bioethics, Oxford: Blackwell, pp. 316-325.): va detto, infatti, che il paziente affetto da malattia rara ha il medesimo diritto alla cura che viene esercitato dagli altri pazienti affetti da malattie non rare, diritto che, in questo caso, si esplica sia come diritto a ottenere trattamenti di comprovata efficacia, sia quale diritto alla speranza nello sviluppo di nuovi possibili trattamenti, grazie ai progressi della ricerca farmacologica. I due diritti sono impliciti nel Preambolo costitutivo dell’Organizzazione Mondiale della Sanità, secondo cui «il possesso del miglior stato di salute che si è capaci di raggiungere, costituisce un diritto fondamentale di ogni essere umano» (Callahan 197314Callahan, D. (1973) The WHO definition of “health”, Studies Hastings Center, 1: 77-88.).
In conclusione, le malattie rare rappresentano una priorità di sanità pubblica riconosciuta, almeno formalmente, all’interno di un percorso normativo, europeo e internazionale, che vede anche i governi dei paesi dell’UE impegnati su questo fronte. Tuttavia, il settore delle malattie rare costituisce ancora una sfida di natura etica, politica e sociale, laddove la ricerca scientifica e la pratica clinica necessitano sempre più di coinvolgere non solo pazienti, medici, ricercatori, ma anche diversi stakeholder, inclusi aziende, legislatori, politici e professionisti sanitari, al fine di rendere accessibili i saperi scientifici e le pratiche cliniche ai malati e alle famiglie, mediante dinamiche di trasparenza e di inclusione, quali i network nazionali e internazionali (Mikami, Sturdy 201715Mikami, K., Sturdy, S. (2017) Patient organization involvement and the challenge of securing access to treatments for rare diseases: report of a policy engagement workshop, Research Involvement and Engagement, 3(14): 1-13.).